朱雪琴《过氧化氢制取氧气的实验探究》教学设计
发表日期:2008/10/30 14:52:32 作者:蔡军 有4928位读者读过
《过氧化氢制取氧气的实验探究》教学设计
南京市上元中学 211100 朱雪琴
一、教学目标
知识与技能:
(1)认识过氧化氢溶液,认识过氧化氢溶液制取氧气的优点和缺点。
(2)了解催化剂在化学反应中的作用和特点,探究并寻求过氧化氢溶液分解制取氧气的较为合理的催化剂。
(3探究用过氧化氢溶液制取氧气的可以控制的装置。
过程与方法:
(1)通过探究实验培养学生发现问题并解决问题的能力。
(2)通过本节课的学习,培养学生分析、对比、迁移知识的能力。
情感态度与价值观:
(1)知道化学与生产和生活的联系。
(2)通过探究活动,提高学生学习兴趣,激发求知欲,培养学生科学素养。
(3)培养学生勇于创新的科学精神和团结合作的意识。增强社会责任感,养成良好的环保意识。
二、教学模式
基于问题讨论式
三、教学准备
教师准备:制作Powerpoint课件、10℅过氧化氢溶液、30℅H2O2溶液、 各种催化剂(MnO2、土豆块、新鲜猪肝、红砖瓦粉、铜丝网、CuSO4溶液、FeCl3溶液等)、烧杯(500mL)1只、试管(18×180)10支、托盘天平、酒精灯、木条、铁架台(带铁夹)、大试管、分液漏斗、带导管的双孔橡皮塞、吸滤瓶、分液漏斗、带导管的双孔橡皮塞铜丝(一端系上装有二氧化锰粉末的小砂袋)、集气瓶等
学生准备:①查阅用过氧化氢制氧气的可能的催化剂
②课前拆干电池找MnO2;找新鲜猪肝、土豆块、红砖瓦粉、铜丝、点滴板(或可代用品)等物品。
③寻找各种随时发生随时停止制氧装置所需物品(废弃的塑料瓶、医用注射器、皮管、玻璃管等)。
四、教学过程:
(一)认识双氧水
|
师生活动 |
设计意图 |
|
师:举例说明双氧水已大量运用到生活和生产中 师:出示一瓶双氧水溶液,倒少量液体于试管中。 生:同样操作,观察。 师:双氧水溶液在常温下能生成氧气吗?(问题1) 生:有或没有等不同的回答…… 师:为什么? 生:基于问题1分析讨论,动手进行“活动与探究一” 实验并记录。 师:总结学生结论并示范操作。 生:书写过氧化氢溶液分解生成氧气的表达式。 师:如用此反应作为实验室制取氧气有什么优点和缺点?(问题2) 生:分析、评价。 师:如何改进?(问题3) 生:基于问题3分析讨论。课前预习查阅催化剂信息。 |
创设情景,引起学生的兴趣 直接导出研究对象,导入新课。 提出问题。 教师的追问帮助学生进入思考并引导学生一定要用实验来探究的意识。 修正结论。 得出正确结论。 并引出下一个内容 培养分析问题能力 引出催化剂 |
(二)双氧水分解反应的催化剂
|
师生活动 |
设计意图 |
|
师:哪些物质可加快双氧水分解反应的速度?(问题4) 生:介绍各种从资料中查到的物质…… 师:这些物质确实有效吗?(问题5) 生:动手进行“活动与探究二”并记录。找出较为合理的催化剂 师:何以证明它们具有催化剂的特点?(问题6) 生:设计实验方案。 师:分析有些催化剂(如MnO2)在过滤、烘干、称量等实验操作中的繁琐之处,提出较易证明的方案。 师:演示实验。(实物投影) 生:完善过氧化氢溶液分解生成氧气的表达式。(添上条件催化剂) |
培养学生查阅资料的意识。 在课本基础上拓展提高 引导学生实验。 考虑各种因素进行评价。 引导学生回忆催化剂的特点。 灌输实验创新的意识。发现问题和解决问题的能力得以提高。 真正理解催化剂的概念,消除 疑惑。 修正提高。 |
(三)过氧化氢溶液制取氧气
|
师生活动 |
设计意图 |
|
师:用双氧水和二氧化锰来制氧气,要用到固体和液体,并且反应速率很快,我们应选择怎样的装置呢?(问题7) 投影: 生: 师:将二氧化锰和双氧水直接装入一支试管内,是否可行?(问题8) 投影:
师:那怎样才能将固体和液体分开呢?(问题9) 生:将液体装在漏斗里,固体装在试管中。 投影:
师:这样可行吗? 生:不可行,因为短时间内有大量双氧水与二氧化锰接触,反应速率很快,产生大量气体,有可能造成爆炸;漏斗造成装置漏气。 师:选用怎样的装置才能控制双氧水的量,进而控制反应速率呢?(问题10) 生:思考、分析 师:要控制反应速率,就要逐滴滴加双氧水,因此可在漏斗上加一个活塞――分液漏斗(图一);也可通过小砂袋的上升和下降来控制反应的随时发生随时停止(图二)。
生:利用自带用品按上述原理组装各种反应装置。 师生共同讨论收集方法和装置 生:分组实验,进行“活动与探究三”并记录。每组用两种制取和收集氧气的方法制取两瓶氧气。 讨论:实验过程中出现的问题。 师:小结本节内容和反思 |
介绍制取原理 出现的仪器为学生后续思考铺垫 在老师的启发下,层层深入 让学生在简单的实验中,体会科学探究的过程。 问题的深入,导致学生思考的深入,培养学生的创造能力 启发引导,抛砖引玉 强化实验基本操作能力和动手能力 |
五、实验改进说明:
《义务教育课程标准实验教科书化学九年级(人教版)上册》第二单元课题3制取氧气中安排了用过氧化氢溶液制取氧气的内容,如按书上的实验内容教学,始终留下一些疑惑,针对下列问题,在本节课中做了以下的实验改进:
(一)、过氧化氢溶液在常温下能生成氧气的实验改进
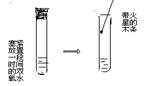
课本中对这部分内容是这样安排的:在试管中加入 5 mL 10%的过氧化氢溶液,把带火星的木条伸入试管,木条不复燃,但说明了“过氧化氢溶液在常温下能生成氧气”结论。显然这样的结论会使学生感到矛盾。将5 mL 10%的过氧化氢溶液放置一天(用橡皮塞塞紧),再把带火星的木条伸入试管,木条就会复燃,建立在实验基础上,学生对“过氧化氢溶液在常温下能生成氧气”就会变得清晰。
(二)、催化剂概念的理解
因过滤操作安排在第三单元课题3水的净化中,在本课题的学习中较难安排将催化剂二氧化锰过滤出来,而且烘干称量实验操作也较为繁琐,难在有限的课堂时间上完成,如没有相应的实验基础,学生对催化剂“在化学反应前后质量不变”形成不了概念,也就无法更好地揭示催化剂概念的内涵。
1、实验用品
烧杯(500mL)1只、试管(18×180)2支、铜丝网(3cm×3cm)、铜丝、30℅H2O2、托盘天平
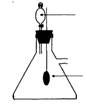
2、实验装置(如下图)
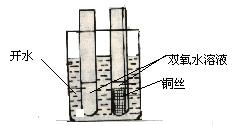
3、实验步骤
(1)取一块3cm×3cm铜丝网,卷成圆筒形,用一根约25 cm长的铜丝相连,并称重。
(2)分别向2支试管中注入约1/3体积、浓度为30℅H2O2
(3)将2支试管放入盛有开水的烧杯中,约1min后可观察到小气泡产生。
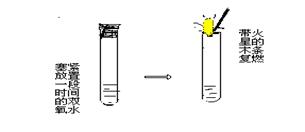
(4)把带有铜丝的铜丝网放入其中的一支试管中,可观察到试管中有大量的气泡产生,随即将铜丝网撤离液面则反应速度又恢复到原来的水平,反复实验,上述现象重复出现直到H2O2的分解反应完成。
(5)待反应完成后取出铜丝,用滤纸或卫生纸将铜丝网上的液体吸干,然后称量,可观察到铜丝网的质量不变。
此实验快速简单、操作方便,可明显地观察到反应速度的改变、反应前后催化剂的外观和质量均不改变,从而很好地揭示催化剂的概念,本实验所用的铜丝和铜丝网也可用铁丝和铁丝网代替。
(三)、用过氧化氢溶液制取氧气的实验
 实验室制备气体装置的选择,往往是由制备气体的方法(原理)决定的。用化学方法制取气体,就需要考虑反应中反应物的状态和反应条件。用过氧化氢溶液制取氧气的实验条件为常温,反应物的状态为固体和液体,所选装置如图1所示。
实验室制备气体装置的选择,往往是由制备气体的方法(原理)决定的。用化学方法制取气体,就需要考虑反应中反应物的状态和反应条件。用过氧化氢溶液制取氧气的实验条件为常温,反应物的状态为固体和液体,所选装置如图1所示。
图1
缺点:
1. 在实验操作中,很难做到使反应随时发生随时停止(即很难做到使过氧化氢溶液与MnO2粉末分离而使反应停止)。
2. 无法控制液体药品的用量,浪费药品。
因此做了适当的改进:
改进一
1. 改进所需器材
铁架台(带铁夹)、大试管、分液漏斗、带导管的双孔橡皮塞。
2. 改进后的发生装置如下图2所示:
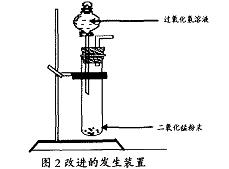
3. 操作方法
①先将少量的二氧化锰粉末放入大使管的底部。
②然后将过氧化氢溶液放入分液漏斗中,打开活塞,逐滴加入过氧化氢溶液,使反应停止。
③不需产生气体时将活塞关闭,使反应停止。
4. 改进后发生装置的优点
①通过分液漏斗逐滴向试管加入过氧化氢溶液来控制反应的速度,可以得到平稳的氧气流,同时也便于收集。
②可以控制所加过氧化氢溶液的用量,节约药品。
③操作简便。
改进二
1. 1. 改进所需器材
吸滤瓶、分液漏斗、带导管的双孔橡皮塞铜丝(一端系上装有二氧化锰粉末的小砂袋)
 2.改进后的发生装置如图3
2.改进后的发生装置如图3
3. 操作方法
①按上图将一根铜丝(一端系上装有二氧化锰粉末的小砂袋),伸入到吸滤瓶底部。
②将过氧化氢溶液放入分液漏斗中,通过分液漏斗逐滴加入5℅过氧化氢溶液,使反应发生,产生气体。
③不需产生气体时将铜丝向上拉起,将小砂袋脱离液面,使反应停止。
4. 改进后发生装置的优点
①通过控制滴加过氧化氢溶液的用量来控制反应的速度。
②能通过小砂袋的上升和下降来控制反应的随时发生随时停止。
③操作简便,节约药品。
六、学生实验活动记录
实验用品:试管(7支)新鲜猪肝 土豆 红砖瓦粉 二氧化锰 硫酸铜溶液 氯化铁溶液木条 酒精灯 火柴 试管架 抹布 废液缸 废塑料瓶 单双孔橡皮塞 导管 注射器 集气瓶 线和纱布
活动与探究一:双氧水在常温下能否生成氧气?
|
操作步骤 |
实验现象 |
实验现象 |
|
倒1-2毫升10℅过氧化氢溶液于试管中 |
|
|
|
将带火星的木条伸入试管中 |
|
|
|
|
|
|
活动与探究二:有关催化剂的探究
|
操作步骤 |
实验现象 |
实验现象 |
|
分别在标号序号的6支试管中加入1-2毫升10℅过氧化氢溶液(①新鲜猪肝②红砖瓦粉③二氧化锰粉末④硫酸铜溶液⑤氯化铁溶液⑥土豆块),并将带火星的木条伸入各试管中 |
|
|
|
反应停止后,再加入1-2毫升℅过氧化氢溶液,再将带火星的木条伸入各试管中 |
|
|
|
观察教师的演示实验
|
|
|
活动与探究三:探究随时发生随时停止制取氧气装置
|
操作步骤 |
实验问题 |
实验结论 |
|
按发生装置和收集装置组装随时发生随时停止制取氧气装置 |
|
|
|
装置气密性检查 |
|
|
|
装药品 |
|
|
|
收集 |
|
|
|
验满 |
|
|
备案号:苏ICP备2021048345
 苏公网安备32011502010427号
苏公网安备32011502010427号